Analyse des chiffres de 2021 à 2023
Le système de « patent linkage » a été établi en Chine en 2021 à l’occasion de la 4e révision de la loi sur les brevets, avec l’entrée en vigueur en juillet 2021 d’une série de mesures d’exécution et d’interprétations judiciaires prévoyant des dispositions concrètes et la mise en place d’une plateforme d’enregistrement d’informations sur les brevets liés aux médicaments commercialisés (voir notre article : « Patent linkage » : aperçu du nouveau système chinois). Dans cet article, nous allons analyser des données statistiques compilées dans le cadre du “patent linkage” de juin 2021 à septembre 2023 et en tirer quelques enseignements utiles notamment pour les entreprises pharmaceutiques.
I – Analyse des statistiques
A- Évolution du nombre de brevets enregistrés sur la plateforme et du nombre de déclarations déposées à l’encontre des brevets
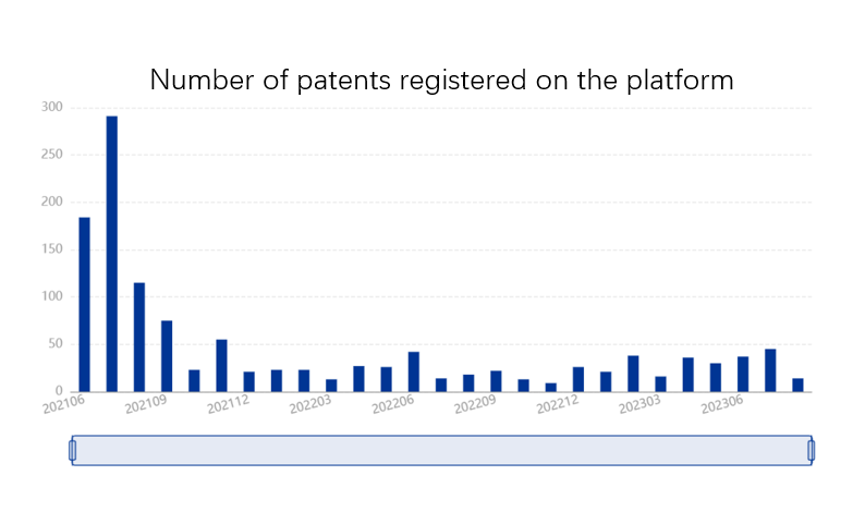
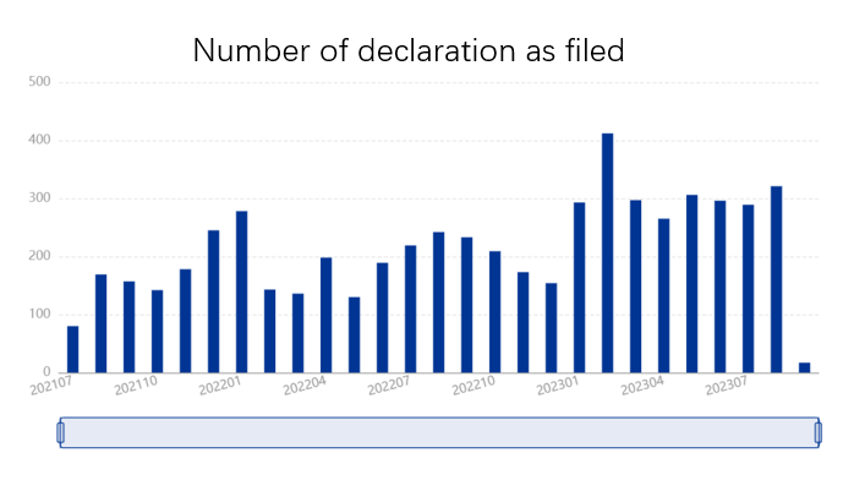
Tout d’abord, et pour rappel, il existe quatre types de déclaration :
– Déclaration de type 1 : il n’y a aucun brevet pertinent enregistré sur la plateforme.
– Déclaration de type 2 : le brevet pertinent a déjà expiré, a été invalidé ou bien le génériqueur est déjà licencié pour ce brevet.
– Déclaration de type 3 : le génériqueur promet de ne pas commercialiser le médicament générique avant l’expiration du brevet pertinent.
– Déclaration de type 4 : le brevet pertinent doit être invalidé (type 4.1), ou le médicament générique n’entre pas dans la portée de protection de ce brevet (type 4.2).
A partir des statistiques ci-dessus relatives au nombre de brevets de médicaments enregistrés sur la plateforme et à celui des déclarations déposées entre juin 2021 et septembre 2023, nous pouvons tirer les conclusions préliminaires suivantes :
(1) Peu après le lancement officiel du système de “patent linkage” en juin 2021, un grand nombre de titulaires de brevets de médicaments existants ont “rattrapé” leurs enregistrements sur la plateforme, d’où les nombres élevés pour les premiers mois. Le nombre d’enregistrements a ensuite diminué et s’est stabilisé au fur et à mesure.
(2) Le nombre de déclarations déposées est relativement stable, malgré des fluctuations. D’une part, il est lié, avec un certain décalage, au nombre d’enregistrements des brevets de médicament, et d’autre part, il est affecté par divers facteurs, tels que la demande du marché et les stratégies commerciales. Nous constatons une augmentation globale du nombre de déclarations en 2023, ce qui est peut-être lié à la fin de l’épidémie de Covid et à une stratégie commerciale plus agressive des entreprises.
B- Profil des titulaires des brevets de médicaments enregistrés sur la plateforme
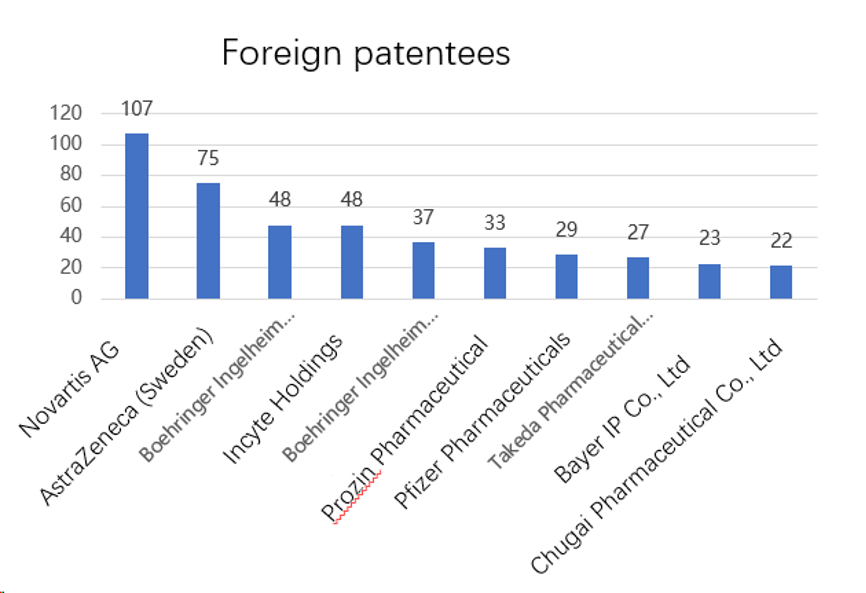
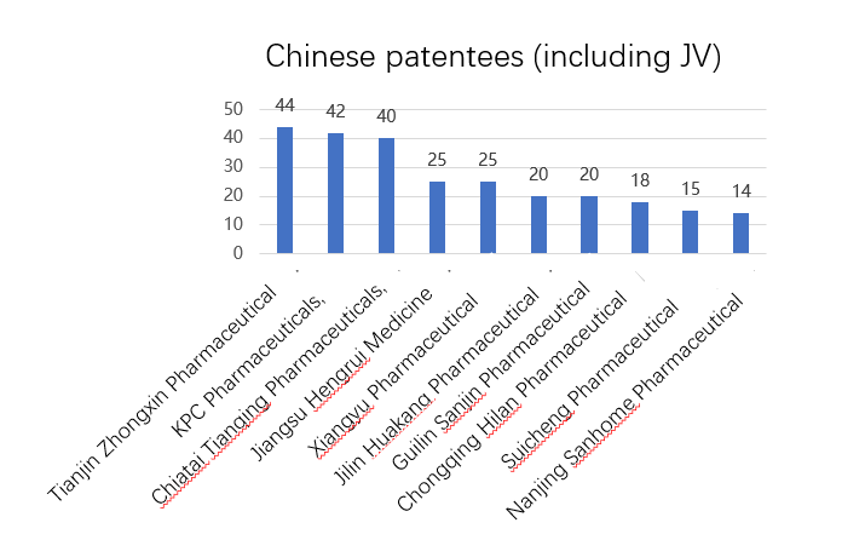
Comme illustré sur les deux figures ci-dessus, le nombre de brevets des principaux titulaires étrangers publiés sur la plateforme est nettement plus élevé que celui des titulaires chinois. Novartis, qui détient la 1ère position au sein des entreprises étrangères, détient presque 2,5 fois plus de brevets que Tianjin Zhongxin. Le nombre de brevets publiés des titulaires étrangers occupant d’autres positions est également plus élevé que celui des titulaires chinois occupant les positions correspondantes.
C- Principales entreprises ayant déposé des déclarations
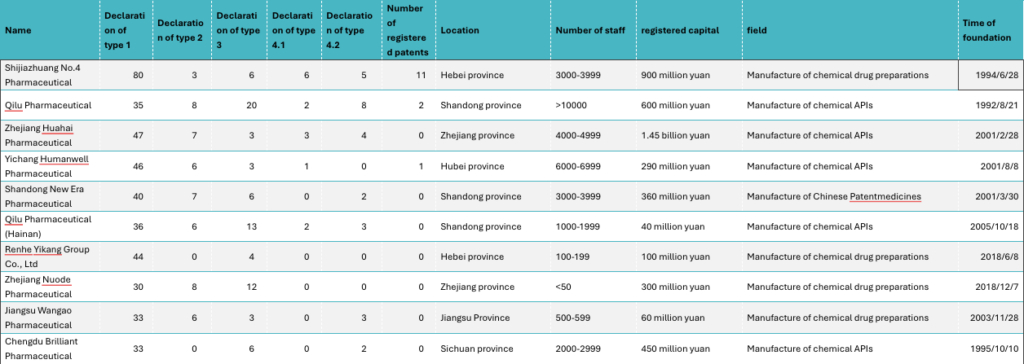
Une analyse préliminaire de ce tableau permet de faire les constatations suivantes :
(1) La plupart des déclarations déposées sont de type 1, et le nombre de déclarations de type 4 est très faible.
(2) A l’exception de quelques entreprises (parmi lesquelles Shijiazhuang No.4 Pharmaceutical, qui occupe la première place et a enregistré 11 brevets), la plupart des entreprises qui ont déposé des déclarations n’ont pas enregistré de brevets et/ou ne disposent pas de brevet enregistrable sur la plateforme.
(3) Le faible nombre de déclarations de type 4 et de brevets enregistrés pourrait refléter dans une certaine mesure le fait que la plupart des génériqueurs chinois sont encore peu innovants.
D- Top 10 des médicaments visés par des déclarations
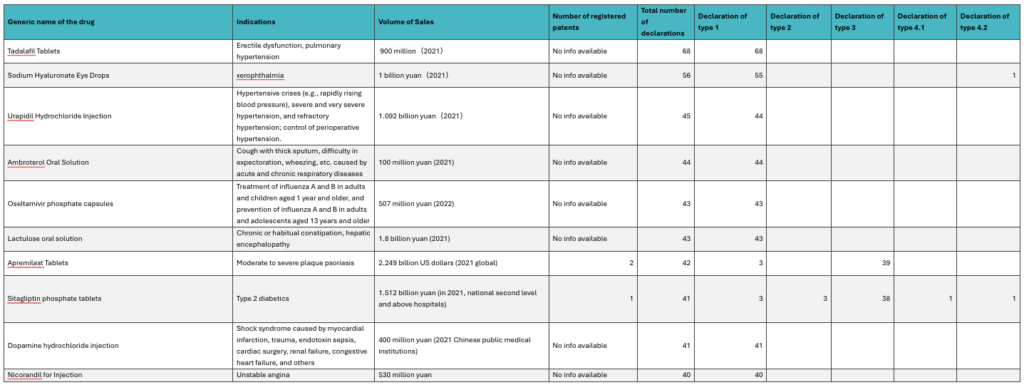
Une analyse préliminaire de ce tableau permet d’avancer que :
(1) la plupart des médicaments qui ont été visés par un nombre élevé de déclarations ont fait l’objet de déclarations de type 1, mais il est aussi arrivé qu’un médicament donné fasse l’objet de déclarations de type 1, 2, 3 et 4 en même temps.
(2) la plupart des médicaments visés par les déclarations ont des indications qui concernent des maladies courantes.
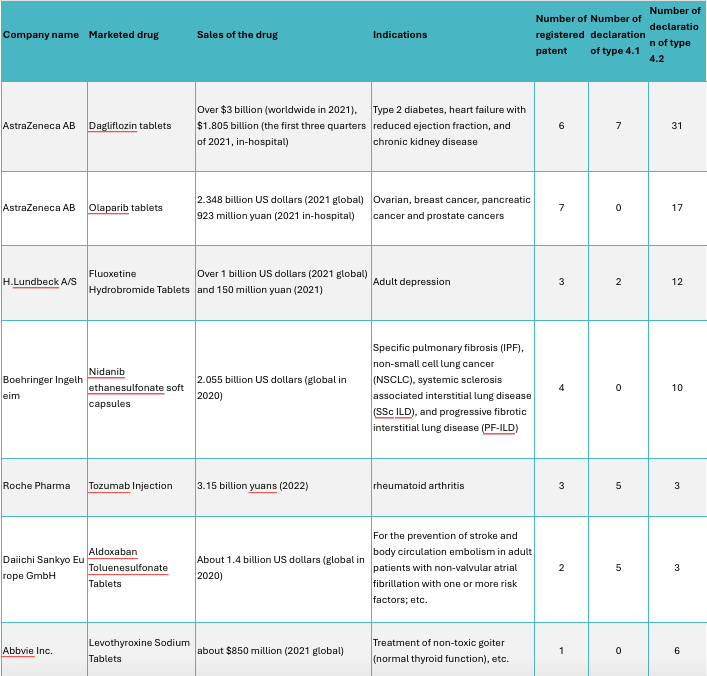
E- Médicaments représentatifs pour lesquels des déclarations de type 4 ont été déposées
Nous pouvons constater que c’est le médicament Dagliflozine d’AstraZeneca qui a reçu le plus grand nombre de déclarations de type 4, avec 31 déclarations de type 4.2, dépassant largement les autres médicaments. Son chiffre d’affaires est également plus élevé que celui des autres médicaments.
F- Types de déclarations
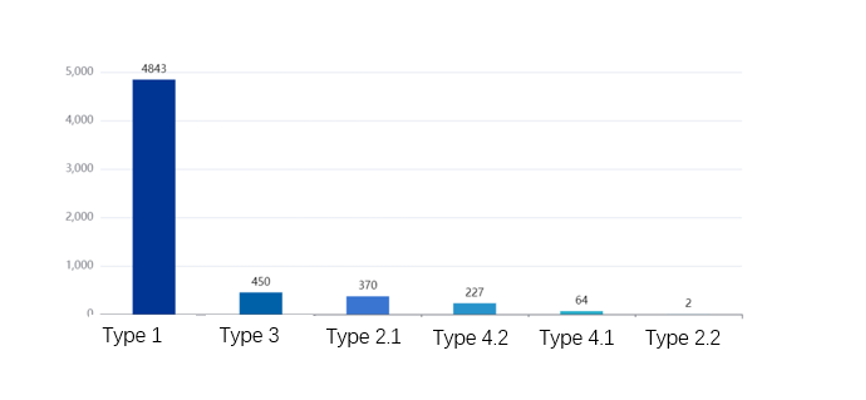
D’après cette figure, les déclarations de type 1 sont les plus nombreuses, suivies par les déclarations de type 3. La prédominance des déclarations de type 1 peut s’expliquer par le fait que les informations disponibles sur la plateforme ne sont pas encore complètes (par conséquent, on peut imaginer que les génériqueurs évitent de s’y fier entièrement et consultent d’autres bases de données), et celle des déclarations de type 3 par le fait que la plupart des brevets listés sur la plateforme ont été mis en œuvre par les génériqueurs.
G- Résultats de traitement des déclarations de type 4.2
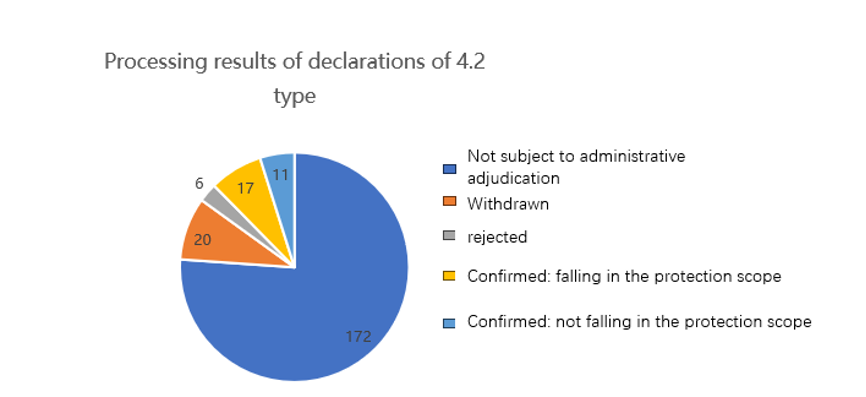
Cette figure montre que le nombre de décisions administratives est bien inférieur au nombre de déclarations de type 4.2 déposées. Plus précisément, environ 75 % des déclarations de type 4.2 n’ont pas fait l’objet d’une adjudication administrative ou ne l’ont pas menée à son terme. Cela pourrait signifier que, dans le cadre de ces déclarations, les parties concernées ont choisi d’autres moyens pour résoudre leurs différends, tels que la négociation privée ou le recours à la voie judiciaire. Plusieurs raisons peuvent expliquer ce phénomène. D’une part, certaines parties peuvent considérer que les procédures de résolution des différends par voie administrative sont trop compliquées ou prennent trop de temps, et choisissent donc une manière plus rapide et plus simple pour régler leur différend. D’autre part, certaines parties peuvent estimer que leurs droits et intérêts seront mieux protégés par le biais, par exemple, d’une négociation privée ou d’une procédure judiciaire, et choisissent donc ces voies.
H- Durée des différentes voies
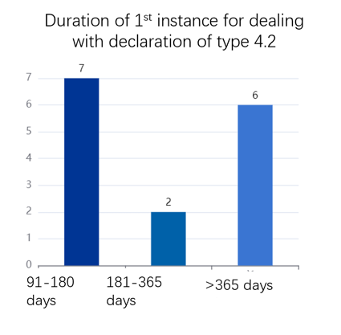
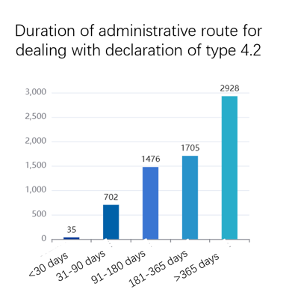
Comme nous pouvons le déduire de ces deux figures, il est difficile, dans la plupart des cas, d’achever en 9 mois (durée qui correspond, pour rappel, à la période d’attente) toute la procédure (voie administrative + éventuel recours ou voie judiciaire) nécessaire pour résoudre des différends provoqués par des déclarations de type 4. A titre de comparaison, aux États-Unis, la période d’attente est de 30 mois. Cet écart est lié aux caractéristiques de l’industrie pharmaceutique dans les deux pays.
II – Principales conclusions
(i) Depuis la mise en place du système de « patent linkage », des centaines de génériqueurs ont déposé des déclarations, la concurrence est donc féroce et le degré d’homogénéisation des produits est élevé.
Les données montrent que le nombre d’entreprises ayant déposé des déclarations s’élève à 1352, parmi lesquelles on voit à la fois de grands génériqueurs tels que Shijiazhuang No.4 Pharmaceutical, mais également 492 petites entreprises pharmaceutiques qui ne font des demandes que pour un seul médicament. Le nombre de déclarations est fortement lié à la taille de l’entreprise.
Si l’on prend l’exemple du médicament « Tadalafil Tablet », qui a reçu le plus grand nombre de déclarations de la part des génériqueurs : 36 entreprises ont déposé un total de 68 demandes de mise sur le marché pour leurs médicaments génériques “Tadalafil”, tous en comprimés, ce qui montre une faible diversité de produit. À l’heure actuelle, le marché n’est pas encore saturé et aucune entreprise leader n’a émergé. Cependant, le seuil d’entrée pour de nouvelles entreprises étant élevé, il existe de nombreuses opportunités de développement en interne.
(ii) Les entreprises étrangères détiennent le plus de brevets relatifs à des médicaments princeps
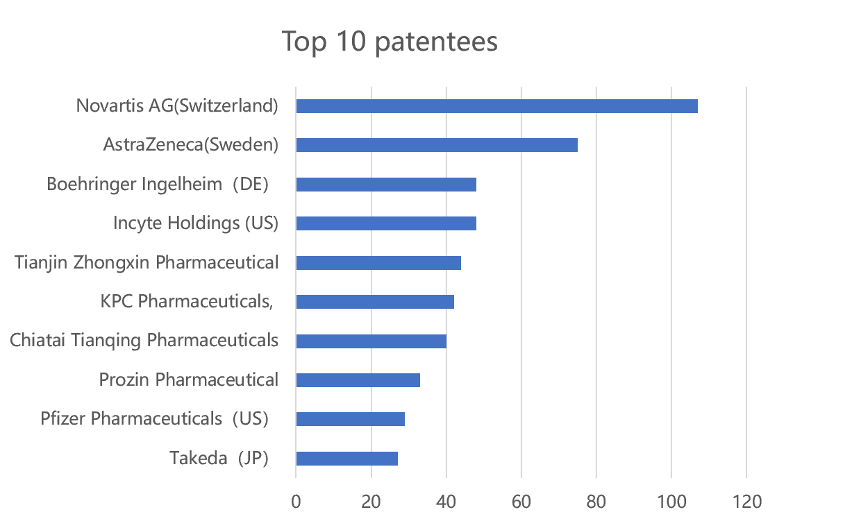
Parmi le Top 10 des titulaires de brevets relatifs à des médicaments princeps, les entreprises étrangères prennent 6 places et le Top 4 n’est constitué que d’étrangers. Cela montre un écart important entre les entreprises étrangères et chinoises en matière de capacité d’innovation dans le domaine pharmaceutique.
(iii) Les génériqueurs chinois sont encore faibles en innovation
1) Les déclarations déposées par des génériqueurs étaient principalement de type 1 et de type 3, ce qui ne permet pas de refléter le caractère innovant des médicaments génériques et ne remet pas en cause les brevets existants. Cela indique que, dans le système de “patent linkage”, certains génériqueurs chinois pourraient être plus enclins à contourner les risques liés aux brevets par le biais de déclarations plutôt que par l’innovation pour obtenir un avantage sur le marché. De plus, le fait que le nombre des déclarations de type 4.1, pouvant refléter le caractère innovant des médicaments génériques, est le plus faible pourrait signifier qu’il y a toujours très peu d’innovation réelle dans le secteur des médicaments génériques.
2) Actuellement, aucun génériqueur n’a réussi à « activer » la période d’exclusivité. Cela peut être dû au fait que les génériqueurs ont encore des difficultés et des défis en matière de R&D et de production, ce qui les empêche de concurrencer les entreprises de médicaments princeps.
Pour rappel, le premier génériqueur qui a réussi un « patent challenge », c’est-à-dire qui a déposé une déclaration de type 4.1 contre le brevet pertinent, a ensuite réussi à invalider ce brevet et a obtenu l’AMM pour son médicament générique, profite d’une période d’exclusivité du marché de 12 mois à compter de la date d’obtention de l’AMM. Pendant cette période d’exclusivité du marché, les autres médicaments génériques de même genre ne seront pas autorisés à entrer sur le marché.
3) En analysant les chiffres des déclarations, on voit que les premiers médicaments qui ont été visés par des déclarations étaient des médicaments destinés à soigner des maladies courantes. Cela montre que sur le marché pharmaceutique, de tels médicaments font encore l’objet d’une forte demande et ont un volume de vente important. Toutefois, ces derniers ont un faible lien avec les brevets impliqués dans les médicaments et leur statut juridique, ce qui reflète, dans une certaine mesure, le manque d’informations ou de connaissance du marché par ses acteurs. Cela pourrait signifier que, sur le marché pharmaceutique, certaines entreprises pourraient se concentrer plutôt sur les ventes que sur l’innovation, alors qu’il existe des lacunes dans la réglementation du marché.
Nos commentaires et recommandations
(i) Consulter de manière exhaustive les informations pertinentes sur les brevets et effectuer des recherches et des évaluations sur les brevets à l’avance
Afin d’éviter les risques de contrefaçon de brevet dus aux restrictions sur les types de brevets enregistrés sur la plateforme et aux informations d’enregistrement incorrectes ou manquantes, il est essentiel de procéder à une détection des médicaments ainsi qu’à une recherche complète d’informations sur les brevets concernant le produit générique proposé au cours du processus d’établissement du projet. Il s’agit notamment d’identifier les brevets susceptibles d’avoir un impact sur l’activité de l’entreprise par le biais d’une enquête approfondie et d’une évaluation des risques potentiels liés aux brevets. De cette manière, les potentiels actes de contrefaçon peuvent être identifiés à l’avance et évités.
En outre, une compréhension plus complète du statut et de l’histoire des brevets peut être obtenue en examinant les documents administratifs et judiciaires existants. Cela permet de prévoir l’orientation future des brevets et donc de mieux formuler les stratégies de réponse.
(ii) Etablir à l’avance une stratégie de remise en cause du brevet pertinent
Remettre en cause un brevet pertinent (ou “Patent challenge”) est un moyen efficace permettant d’éliminer les obstacles imposés par le brevet ou d’obtenir d’autres avantages commerciaux. Il s’agit notamment de réduire la probabilité de contrefaçon ou d’accroître les avantages commerciaux en contestant la validité ou l’étendue de la protection des brevets d’autrui.
Pour mettre en œuvre avec succès une stratégie de “patent challenge”, il est nécessaire d’avoir une compréhension approfondie du brevet visé. Pour ce faire, il convient de vérifier son statut juridique et le comparer avec d’autres documents afin de mieux évaluer ses forces et ses faiblesses. Il pourrait également être utile de consulter les documents historiques d’examen de ce brevet, les documents produits dans d’éventuelles procédures administratives et/ou judiciaires liées à ce brevet.
(iii) Transformation des talents en R&D : de « forts en technologie » à » forts en technologie et en propriété intellectuelle »
Afin de mieux s’adapter à l’environnement concurrentiel de l’industrie pharmaceutique, les talents en R&D doivent passer du type se concentrant sur la technologie à celui maîtrisant à la fois la technologie et la propriété intellectuelle. Pour ce faire, les trois aspects suivants doivent être remplis.
Tout d’abord, il est nécessaire de collecter et d’analyser de manière exhaustive les produits pharmaceutiques et les informations en matière de brevets. Il s’agit notamment de rassembler les catalogues de médicaments commercialisés par des fabricants de médicaments princeps, les déclarations sur des brevets déposées par des génériqueurs et les informations liées à ces brevets, et d’effectuer des analyses croisées, et ce afin d’améliorer la maîtrise et la capacité d’application des connaissances en matière de brevets liés à la technologie.
Deuxièmement, il convient de se familiariser avec les procédures et les stratégies d’invalidation de brevets. Lorsque vous déposez une demande d’autorisation de mise sur le marché pour un médicament générique, vous devriez également envisager de lancer une action en nullité à l’encontre du brevet pertinent. Vous pourrez ainsi vous assurer une position avantageuse face à la concurrence et éviter les risques potentiels de contrefaçon.
Enfin, il est important de se familiariser avec les lois et règlements pertinents ainsi qu’avec les cas typiques. Le système de “patent linkage” est un système interdisciplinaire, et les futures applications juridiques pourraient impliquer la loi sur l’administration des médicaments et les mesures de gestion de l’enregistrement des médicaments, la loi des brevets, la loi des contrats, la loi anti-monopole, la loi de la procédure civile etc. Cela impose des exigences plus élevées en ce qui concerne les talents juridiques de l’entreprise, qui sont censés avoir un profil interdisciplinaire et une expérience pratique.
En résumé, il est essentiel pour les acteurs de l’industrie pharmaceutique d’avoir une compréhension et une maîtrise approfondies des produits pharmaceutiques et des informations en matière de brevets qui y sont associés, d’élaborer des stratégies efficaces de “patent challenge” et de développer des talents en R&D dotés de capacités « technologie + propriété intellectuelle ». Ces mesures peuvent aider les entreprises à conserver une position de leader sur un marché concurrentiel et à assurer un développement solide de leurs activités.
Par Xiang PU et Boyun LI de IP house

