PTE possible désormais en Chine ?
Comme annoncé précédemment, nous publions une série d’articles consistant à présenter les changements majeurs prévus dans le cadre de la récente révision du règlement d’application de la loi chinoise sur les brevets (ci-après « le nouveau règlement ») et des directives d’examen de brevets (ci-après « les nouvelles directives »). Voici le 6ème article de cette série, dédié aux clarifications apportées par ces deux textes concernant le nouveau régime dit de PTE (Patent Term Extension en anglais, ou extension de la durée du brevet en français).
Pour rappel, à l’occasion de la 4ème révision de la loi chinoise des brevets, deux nouveaux régimes, dits de PTA et de PTE, ont été mis en place. Nous nous concentrons ici sur le PTE (voir notre précédent article « Ajustement de la durée des brevets en Chine » pour le PTA).
Pourquoi un PTE ?
Le domaine pharmaceutique est celui qui dépend le plus de la protection par brevet. La recherche et le développement de nouveaux médicaments demandent des investissements considérables en temps et en argent et impliquent des risques importants. Sans une protection par brevet, il serait difficile pour les entreprises de nouveaux médicaments de pouvoir récupérer les coûts de R&D et réaliser des profits raisonnables, ce qui pourrait avoir une incidence sur leur motivation à développer de nouveaux médicaments.
En outre, les différents pays ont soumis les médicaments à une réglementation administrative stricte et leur mise sur le marché nécessite une approbation exigeante de la part de l’administration de surveillance des médicaments. Cela signifie que, même si une invention pharmaceutique est brevetée, elle ne peut être mise en œuvre qu’après l’obtention de l’autorisation de mise sur le marché (ci-après « l’AMM »), ce qui réduit objectivement la durée de protection d’un brevet pharmaceutique. Dans le monde entier, les États-Unis ont été les premiers à mettre en œuvre un système de PTE, et depuis lors, le Japon, la Corée du Sud, l’Union européenne, le Canada, etc. ont instauré des systèmes similaires.
Ces dernières années, la Chine a publié une série de documents d’orientation soulignant la nécessité de renforcer encore la protection de l’innovation dans le domaine pharmaceutique et de défendre l’intérêt public et la santé publique. En effet, le développement de médicaments est essentiel pour sauvegarder la santé et à la sécurité de la vie de la population du pays. À l’occasion de la révision de la loi sur les brevets en 2020, le régime de PTE a donc été introduit. Par ce biais, le législateur chinois souhaite renforcer la protection des droits et intérêts légitimes des titulaires de brevets, et donc les encourager à continuer d’investir dans l’innovation des médicaments princeps. Ce système devrait également permettre d’inciter le développement de médicaments génériques afin de réduire leur prix, de façon à garantir leur accessibilité et à protéger l’intérêt et la santé publics.
Dispositions de la loi sur les brevets
Selon l’article 42.3 de la loi, afin de compenser le temps pris par l’approbation de la demande de mise sur le marché d’un nouveau médicament, pour les brevets d’invention liés aux nouveaux médicaments pour lesquels une AMM chinoise a été accordée (ci-après « les brevets de médicament »), l’administration des brevets du Conseil d’État accorde, sur demande du titulaire du brevet, une compensation sur la durée du brevet. Cette compensation ne peut pas dépasser cinq (5) ans et la durée effective totale du brevet après l’approbation de la mise sur le marché du nouveau médicament ne peut pas dépasser quatorze (14) ans.
Cette disposition s’applique donc aux brevets d’invention uniquement, et non aux modèles d’utilités, ni aux brevets de design (ou dessins et modèles). De plus, parmi les différents brevets d’invention, il n’y a que ceux liés aux nouveaux médicaments pour lesquels une AMM a été accordée en Chine qui peuvent bénéficier du PTE.
Le nouveau règlement et les nouvelles directives ont apporté des précisions nécessaires à l’exécution de l’article 42.3. Nous allons voir les principaux aspects traités par ces textes dans la suite de notre article.
La notion de « nouveaux médicaments »
La définition du terme « nouveaux médicaments » n’est pas prévue dans la loi des brevets, ni dans le nouveau règlement. Il ne s’agit pas d’un oubli du législateur. Ce dernier pense qu’il convient d’appliquer les dispositions pertinentes prévues par les lois et réglementations en matière de gestion et de surveillance des médicaments.
Les « mesures de gestion de l’enregistrement des médicaments (2020) » divise les médicaments enregistrés en trois catégories : les médicaments chimiques, les produits biologiques et les médicaments chinois.
Selon les circulaires pertinentes publiées par l’administration de surveillance des médicaments,
– les médicaments chimiques sont divisés en plusieurs catégories :
- médicaments innovants (type 1),
- nouveaux médicaments améliorés (type 2),
- médicaments génériques (types 3, 4), et
- médicaments chimiques déjà mis sur le marché à l’étranger mais pas encore en Chine (type 5).
– les produits biologiques comprennent, entre autres, les produits biologiques à usage préventif et les produits biologiques à usage thérapeutique, qui sont eux- mêmes divisés en trois catégories :
- produits innovants (type 1),
- produits améliorés (type 2), et
- vaccins (ou produits biologiques) déjà mis sur le marché chinois ou à l’étranger (type 3).
La typologie des médicaments chinois étant un sujet compliqué et n’intéressant pas forcément nos lecteurs, nous n’entrerons pas plus dans les détails.
Il est cependant à noter que les médicaments innovants et les nouveaux médicaments améliorés sont tous deux considérés comme des « nouveaux médicaments ». Pour tous les médicaments innovants, le régime de PTE s’applique systématiquement, ce qui n’est pas le cas pour les nouveaux médicaments améliorés. En effet, selon les nouvelles directives (article 3.4 du chapitre VIIII de la partie V), seulement cinq catégories d’entre eux peuvent bénéficier du PTE.
Ainsi, par « brevets d’invention liés aux nouveaux médicaments« , on entend les brevets relatifs aux nouveaux médicaments remplissant les conditions (à savoir, les médicaments innovants + cinq catégories des nouveaux médicaments améliorés prévues par les nouvelles directives), aux procédés de fabrication de ces derniers, et à leurs usages pharmaceutiques. Plus précisément, il est exigé que les revendications désignées d’un tel brevet comportent ou portent sur la substance active du nouveau médicament. Le terme « substance active » (ou encore « principe actif ») désigne généralement une substance active ou un principe actif d’un médicament, qui joue un rôle substantiel dans la prévention, le traitement ou le diagnostic d’une maladie.
Conditions à remplir pour pouvoir demander un PTE
Selon la règle 81 du nouveau règlement et les nouvelles directives, les conditions suivantes doivent être remplies pour avoir le droit de demander un PTE :
(1) la date de publication de la mention de la délivrance du brevet pour laquelle un PTE est demandé doit être antérieure à la date d’approbation de la demande de l’AMM du médicament concerné ;
(2) le brevet en question doit être en vigueur au moment de la demande de PTE ;
(3) le brevet en question ne doit pas avoir déjà bénéficié d’un PTE ;
(4) les revendications du brevet en question doivent comprendre des solutions techniques liées au nouveau médicament pour lequel une AMM a été accordée ;
(5) dans le cas où plusieurs brevets existent simultanément pour un même médicament, le titulaire ne peut demander un PTE que pour l’un de ces brevets ;
(6) dans le cas où un même brevet porte à la fois sur plusieurs médicaments, la demande de PTE peut être présentée pour ce brevet uniquement à l’égard d’un seul de ces médicaments.
Comme nous pouvons le constater, les conditions (3), (5) et (6) précisent qu’un médicament ne peut être utilisé que pour un seul brevet, qu’un brevet ne peut obtenir un PTE que grâce à un seul médicament et qu’un brevet ne peut être compensé dans le cadre d’un PTE qu’une seule fois. Ces limites ont pour but d’équilibrer les intérêts des brevetés et du public, les intérêts des entreprises de médicaments princeps et des génériqueurs, et d’éviter des compensations répétées affectant l’accessibilité aux médicaments.
Dépôt de la demande de PTE
Toujours selon la règle 81 du nouveau règlement et les nouvelles directives :
– la demande de PTE doit être déposée par le titulaire du brevet ;
– en cas d’incohérence entre le titulaire du brevet et le détenteur de l’AMM d’un médicament, le titulaire doit obtenir le consentement écrit de ce dernier lorsqu’il présente la demande de PTE, afin de régler au plus tôt les éventuels différends entre ces deux parties ;
– le titulaire du brevet doit déposer la demande de PTE auprès de la CNIPA dans un délai de trois mois à compter de la date d’approbation de la demande d’AMM du médicament et il doit acquitter la taxe correspondante (dont le montant n’a pas encore été précisé par la CNIPA).
Portée de protection du brevet pendant la période de compensation
Selon la règle 83 du nouveau règlement, pour un brevet d’invention lié à un nouveau médicament, pendant la période de compensation de la durée de ce brevet selon l’article 42.3 de la loi des brevets, sa portée de protection est limitée aux solutions techniques associées à ce nouveau médicament et aux indications approuvées de ce dernier.
Prenons l’exemple d’un nouveau médicament approuvé qui comporte la substance active A1, dont l’indication approuvée est le traitement de l’asthme, et dont la revendication 1 désignée par le titulaire du brevet concerne un composé de formule générale A. Dans la mesure où le composé A1 entre dans le champ du composé de formule générale A, la portée de protection conférée par le brevet pendant la période de compensation est limitée à « l’usage du composé A1 pour le traitement de l’asthme » ou au « composé A1 pour le traitement de l’asthme ». Autrement dit, ladite portée de protection n’est pas celle de la revendication 1 telle que délivrée, encore moins celle de l’ensemble du brevet délivré.
Calcul du nombre de jours du PTE
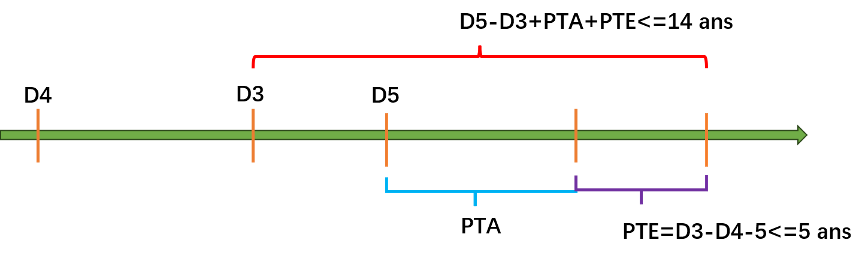
Selon la règle 82 du nouveau règlement, la durée du PTE se calcule selon les formules suivantes :
Durée du PTE = date de l’obtention de l’AMM – Date de dépôt du brevet – 5, et
Durée du PTE ≤ 5 ans.
De plus, la formule ci-après doit être respectée :
Durée effective totale du brevet après l’approbation de l’AMM (≤ 14 ans) = (date d’expiration de 20 ans – date de l’obtention de l’AMM) + durée du PTA + durée du PTE
Afin de rendre nos explications moins lourdes, les formules ci-dessus sont simplifiées comme suit :
PTE = D3 – D4 – 5 ≤ 5 ans ET D5 – D3 + PTA + PTE ≤ 14 ans
dans lesquelles :
– D3 : date de l’obtention de l’AMM du nouveau médicament en question. Attention, en ce qui concerne les médicaments pour lesquels une AMM conditionnelle a été accordée, D3 correspond à la date d’obtention de l’AMM conditionnelle et non à la date d’obtention de l’AMM formelle.
– D4 : date de dépôt du brevet.
– D5 : date d’expiration de 20 ans à compter de la date de dépôt du brevet, i.e. le délai initial du brevet sans compensation.
– PTA : voir notre précédent article « Ajustement de la durée des brevets en Chine ».
En raison de la différence de justification de la compensation, le PTA et le PTE peuvent être « superposés », comme illustré sur la figure ci-dessous. Toutefois, étant donné qu’il existe plusieurs contraintes sur le PTE, il faut calculer la durée du PTA avant de calculer celle du PTE. Bien entendu, le titulaire du brevet peut abandonner son droit de demander le PTA et/ou le PTE.
Examen de la demande de PTE et moyens de recours
Si la demande de PTE remplit les conditions requises, la CNIPA doit prendre la décision d’accorder le PTE. Elle inscrit alors les éléments pertinents (numéro de classement principal, numéro de brevet, date de dépôt, date de délivrance, le nom du médicament et les indications approuvées, date d’expiration de la durée initiale du brevet, date d’expiration de la durée actuelle du brevet) au Registre des brevets et les publie au Bulletin des brevets.
Si, au contraire, les conditions requises ne sont pas remplies, l’Office doit donner au demandeur au moins une occasion pour présenter ses observations et/ou régulariser les documents soumis.
Selon l’annonce n° 560 de la CNIPA, depuis le 20 janvier 2024, les titulaires de brevets, ainsi que toute partie intéressée ayant un litige en contrefaçon ou ayant déposé une demande d’enregistrement du médicament concerné, peuvent, s’ils ne sont pas satisfaits de la décision rendue par la CNIPA en matière du PTE, demander une révision administrative auprès de cette dernière.
Mise à jour au 2 septembre 2024 :
Le 6 août 2024, la CNIPA a publié l’annonce n° 594 sur l’ajustement de certaines normes relatives aux taxes sur les brevets et des politiques de réduction des taxes, ainsi qu’un avis sur les questions y compris celles relatives au paiement des taxes de compensation pour la durée des brevets.
Dans ces deux textes, certains points ont été clarifiés. Tout d’abord, le montant de la taxe pour demander un PTE/PTA est désormais précisé. Pour l’instant, il est fixé à 200 CNY/brevet. En plus de cette taxe, le demandeur doit également acquitter les annuités pour la période de compensation accordée. Ces annuités, d’un montant de 8 000 CNY par an et par brevet, doivent être payées en une seule fois avant la fin de la durée initiale de 20 ans du brevet. Pour la partie inférieure à un an, l’annuité correspondante est exemptée. A titre d’exemple, si le titulaire a obtenu 3,5 ans de compensation, il lui suffira de payer trois annuités, soit un montant total de 24 000 CNY, en une seule fois pour la période de compensation, et ce en plus des annuités normales.
En outre, il est précisé que, pour les demandes de PTA/PTE déposées avant le 26 juillet 2024, le paiement de la taxe de 200 CNY doit être effectué avant le 26 octobre 2024. A défaut de paiement ou en cas de paiement incomplet à la date limite, aucune compensation de la durée du brevet ne sera accordée. Par ailleurs, les annuités pour la période de compensation ne bénéficient pas de délai de grâce comme les annuités normales, et si le délai de paiement est manqué, il ne pourra pas être restauré et le titulaire du brevet ne pourra pas obtenir la compensation.
Article rédigé par Mei TAO